科兴制药(688136.SH)在12月11日举行的投资者调研活动中表示,公司聚焦重点疾病领域,持续立项开发抗体类创新药物,推动在研产品管线的优化,利用 AI、计算机辅助药物设计(CADD)等数字化手段,高效优化药物创新、分子发现路径,获得了多个优秀的 PCC 分子,整体成药性高、安全性高。其中,GB18项目(靶点:GDF15)用于肿瘤恶病质的治疗。
公开资料显示,目前,全球范围内针对GDF-15靶点的单抗药物,已进入临床试验阶段的管线屈指可数,进展较快的有辉瑞Ponsegromab、德国CatalYm的Visugromab等。国内已知GDF-15靶点的在研药物,包括科兴制药GB18项目和云南白药引进康源博创的KA-1641项目等。截至目前,全球尚未有GDF-15靶点的药物获得批准用于肿瘤恶病质的专项治疗。
瞄准新蓝海 市场潜力巨大
生长分化因子15(GDF-15)是1997年发现的一种内分泌激素,又称巨噬细胞抑制性细胞因子1(MIC-1),是转化生长因子β(TGFβ)超家族的一员。其受体是胶质细胞源性神经营养因子(GDNF)家族受体α样(GFRAL)蛋白,受体活化可导致食物摄入减少和体重减轻。当GDF15与GFRAL结合后,RET会发生自磷酸化并导致下游PI3K-AKT、PLC-PKC等信号通路被激活,从而调节众多生理过程,如影响食物摄入、导致体重减轻等。业内人士表示,在肿瘤恶病质中,GDF-15的表达水平显著升高,与肿瘤进展和恶病质程度密切相关。因此,靶向GDF-15的药物研发成为解决肿瘤恶病质这一临床难题的新方向。
中国抗癌协会肿瘤营养专业委员会制订的《肿瘤恶液质临床诊断与治疗指南(2020版)》中提到,肿瘤恶病质(cancer cachexia)发病率高,是各种晚期恶性肿瘤的常见并发症之一,其以骨骼、内脏的肌肉消耗为特征,伴有食欲减退、厌食、饱胀感、体质量下降、肌肉萎缩、乏力、贫血、水肿、低蛋白血症等多种临床表现。有报道显示,60%至80%的肿瘤患者可能出现恶病质,约20%的肿瘤患者死于肿瘤恶病质。
据市场研究机构Mordor Intelligence预测,肿瘤恶病质市场规模预计到2024年为27.2亿美元,预计到2029年将达到33.4亿美元,在预测期内(2024年至2029年)复合年增长率为4.19%。而全球癌症负担的加重也提高了癌症患者对于肿瘤恶病质的患病率,其特征是全身炎症、蛋白质和能量负平衡以及去脂体重的非自愿损失。癌症患者的意外体重减轻和厌食(食欲不振)与体能状态下降、对治疗的反应和耐受性降低、生存率降低以及生活质量降低有关。
布局全球创新药 科创本色渐显
科兴制药2023年年报显示,公司在肿瘤恶病质领域已布局GB18项目,与辉瑞的Ponsegromab靶点和适应症相同。
据悉,辉瑞研发的GDF-15单抗Ponsegromab,旨在通过阻断GDF-15与GFRAL受体结合,从而治疗恶病质。2024年9月14日,在欧洲肿瘤内科学会(ESMO)年会上,辉瑞公布Ponsegromab在临床II期研究中的积极结果。结果显示,与安慰剂相比,接受不同剂量(100mg、200mg、400mg)的患者体重均有显著增长,最高剂量组患者体重平均增长5.6%。Ponsegromab 200mg组患者报告食欲未下降的比例较高;Ponsegromab 100mg和400mg组患者在12周时报告食欲较基线改善,FAACT-ACS评分分别提高4.12和4.5077。Ponsegromab组恶心呕吐发生率较低。
德国CatalYm公司研发的Visugromab是一款人源化单克隆抗体,旨在中和肿瘤产生的GDF-15,以增强免疫细胞对肿瘤的浸润,改善肿瘤杀伤作用。据最新发布于《自然》的论文:Visugromab(CTL-002)临床I/IIa期研究显示,其与PD-1抑制剂(纳武利尤单抗)联合使用,可使一部分已对PD-1/L1抑制剂耐药的患者实现缓解。对接受过免疫治疗等多轮系统性治疗的非鳞状非小细胞肺癌(NSCLC)、尿路上皮癌(UC)和肝细胞癌(HCC)患者,两者联合方案治疗的客观缓解率(ORR)均在20%左右,且均有患者实现完全缓解。
科兴制药GB18项目(靶点:GDF15)用于肿瘤恶病质的治疗,采用独特的纳米抗体结构,药效和稳定性好,表达量(10.0g/L)达到国内先进水平,成本较低,并完成了国际专利布局。
据公司介绍,该项目计划于2025年上半年提交IND临床试验申请。若顺利获批临床,科兴将有望进入GDF-15靶点肿瘤恶病质治疗药物的研发第一梯队。
临床前数据优异 有望成为“Best-In-Class”
近年,科兴制药在研发创新方面投入大量资源,构建了多个前沿技术平台,包括KX-FUSION蛋白技术平台、KX-BODY抗体技术平台等,为GB18的研发提供了强大的技术支持。从其目前公开的管线布局来看,公司正在向创新型新药企业全面转型。
据介绍,GB18采用纳米抗体结构,与传统抗体相比,纳米抗体(Nbs)具有体积小、稳定性好、溶解性好、抗原结合亲和力高、组织渗透性好、生产成本低等特点,是开发下一代生物药的合适基石。科兴制药10月在知名国际学术期刊《mAbs》发布的《GB18-06, a nanobody targeting GDF15, effectively alleviates weight loss and restores physical function in cachexia models》显示,其在研究中对Fc融合的抗GDF-15纳米抗体(GB18-06)体外和体内活性进行了评估。结果表明,GB18显著阻断了人、猴、小鼠不同种属的GDF15与其GFRAL受体的结合(图1),并通过皮下植入HT-1080(人纤维肉瘤)、Renca(小鼠肾肿瘤)或MC38(小鼠结肠癌)癌细胞,在三种不同CC小鼠模型中测试GB18-06对体重减轻和肌肉萎缩的效用。在小鼠的体重平均下降5%时开始给予GB18-06治疗,治疗后逐渐恢复到三种肿瘤模型(即HT-1080)的基线水平(图2),表明GB18-06在癌症模型中对恶病质引起的体重减轻能有效缓解。可见,GB18有可能成为治疗恶病质的理想治疗药物。
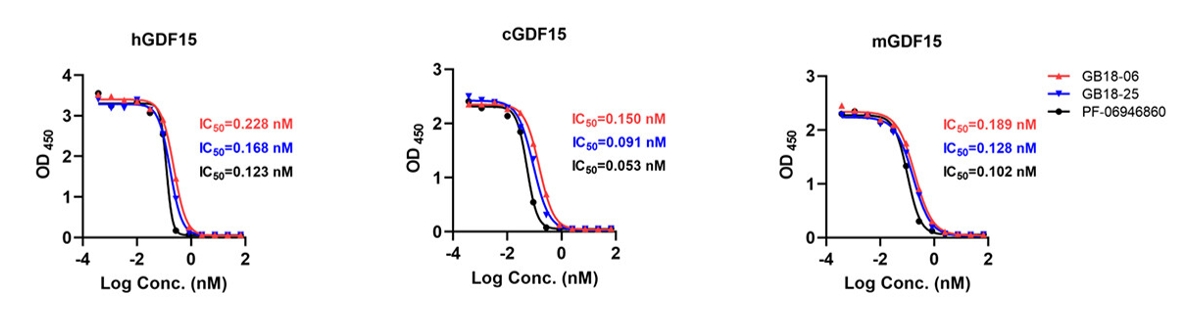
(图1:ELISA检测GB18对hGDF15、cGDF15及mGDF15与其受体的阻断活性)

(图2:GB18缓解CC小鼠模型的体重减轻)
分析人士指出,GB18项目的研发,不仅标志着科兴制药在肿瘤治疗领域的突破,强化了自身市场竞争力,也有望为其在创新药研发领域树立新的里程碑,为公司长远发展注入新的动力。
科兴制药表示,未来公司将继续坚持“创新+国际化”的发展战略,聚焦重点疾病领域研发的同时,积极拓展海外市场,推动创新药的国际化进程,成为高品质生物药领导者。
